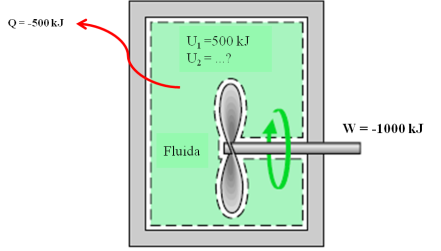
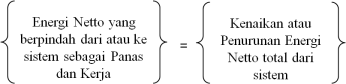TERMOMETRI
A. Konsep Temperatur dan Hukum
ke Nol Termodinamika
1. Konsep Temperatur
Lakukan
percobaan berikut. Masukkan sebongkah es (kira-kira sebesar kepalan tangan)
dengan massa m kilogram (kg) ke dalam beker gelas dan letakkan pada kasa
kaki tiga seperti gambar berikut :
Berapa derajat Celsius
temperatur es mula-mula ? Misalkan - 40C. Nyalakan bunsen bersamaan
dengan mengaktifkan jam henti (stop watch). Amati baik-baik apa yang terjadi
dalam proses pemanasan ini. Peristiwa apa yang mula-mula terjadi ? Peristiwa
apa yang terjadi pada saat proses berlangsung ? Peristiwa apa yang terjadi pada
akhir proses ? Gambarkan semua peristiwa yang terjadi dalam satu grafik !
Apakah grafik yang
diperoleh dari percobaan sesuai dengan grafik berikut ?
Proses AB. Es dengan temperatur – 40C
dipanaskan. Dalam arti, api bunsen memberikan kalor (jumlah panas) kepada
tabung yang berisi es yang mempunyai temperatur lebih rendah dari api bunsen.
Pemanasan dilakukan pada tekanan tetap. Dengan kata lain, pemanasan
dilaksanakan di bawah tekanan udara luar sebesar 1 atmosfer = 1,013 x 105 pascal
(Pa). Akibat pemanasan ini ialah temperatur es naik menjadi 00C. Ini
berarti, ada kalor (jumlah panas) yang digunakan untuk menaikkan rasa panas
(rasa kepanasan atau temperatur) es di bawah tekanan udara luar sebesar 101,3
kPa.
Proses BC. Es dengan temperatur 00C
dipanaskan, sehingga semua es berubah menjadi air dengan temperatur 00C. Ini
berarti ada kalor (jumlah panas) yang digunakan untuk merubah tingkat wujud
(fase) es (padat) menjadi air (cair) di bawah tekanan udara luar sebesar 101,3
kPa. Kenyataannya, pada proses perubahan fase temperatur zat tetap, yaitu 00C. Jadi
pada proses perubahan fase temperaturnya tetap.
Proses CD. Air dengan temperatur 00C
dipanaskan, sehingga temperaturnya naik sampai 1000C. Dalam proses ini ada
kalor (jumlah panas) yang digunakan untuk menaikkan rasa kepanasan atau
temperatur air.
Proses DE. Air dengan temperatur 1000C
dipanaskan, sehingga air berubah fasenya menjadi uap air dengan temperatur 1000C.
Dalam proses ini ada kalor (jumlah panas) yang digunakan untuk merubah wujud
air (fase cair) menjadi uap air (fase gas) dengan temperatur yang tetap di
bawah tekanan udara luar yang tetap, yaitu: 1 atmosfer. Proses perubahan fase
ini berjalan cukup lama, dari proses mendidih sampai pada proses penguapan
secara perlahan-lahan.
Penjelasan di atas memberikan
beberapa hal yang perlu diperhatikan, antara lain:
1. rasa kepanasan (hot)
suatu benda yang disebut temperatur.
2. jumlah panas yang
menyebabkan perubahan rasa kepanasan yang disebut kalor atau bahang (heat).
3. boleh dinyatakan: (a)
temperatur merupakan tingkat atau derajat panasnya suatu benda yang menentukan
arah perpindahan kalor. (b) temperatur merupakan besaran yang dimiliki oleh dua
benda atau lebih yang bersentuhan melalui dinding diatermis yang ada dalam
keadaan setimbang termal. Pada contoh di atas dinding diatermis berwujud tabung
yang terbuat dari gelas.
4.
perubahan fase merupakan perubahan tingkat wujud zat, misalnya: tingkat wujud padat ke cair, tingkat wujud
cair ke gas. Pada proses perubahan fase pada tekanan tetap, temperatur benda
selalu tetap. Kalor yang diberikan atau kalor yang dilepaskan pada saat
perubahan fase harganya juga tetap dan disebut sebagai kalor laten.
5. kalor yang diberikan pada
proses kenaikan temperatur bergantung pada jenis benda dan sebanding dengan
massa benda serta kenaikan temperatur benda. Jenis benda ditandai dengan
besaran yang disebut kapasitas kalor benda. Kapasitas kalor didefinisikan
sebagai perbandingan antara jumlah panas yang diberikan kepada suatu benda dengan kenaikan temperatur benda.
Definisi ini dapat diformulasikan secara matematis sebagai berikut :
c = C : m = dQ /
m dT dengan satuan J kg-1 K-1
biasa
ditulis sebagai berikut :
dQ=
m c dT dengan satuan J
Perubahan fase pada contoh di
atas dapat dijelaskan lebih lengkap dengan gambar berikut.
- Air (H2 O) dalam fase padat bentuk dan volumenya tidak berubah. Air dalam fase padat disebut es. Jika es dinaikkan temperaturnya, es mulai mencair dan akhirnya es berubah menjadi air semuanya. Dalam perubahan fase dari fase padat ke fase cair temperatur zat tetap dan disebut sebagai titik lebur. Kalor yang terlibat dalam perubahan fase ini disebut kalor laten, dalam hal ini disebut kalor lebur. Sedangkan proses perubahan fase padat ke fase cair disebut mencair.
- Air (H2 O) dalam fase cair disebut air. Air volumenya tetap tetapi bentuknya berubah-ubah sesuai dengan wadahnya. Jika air dinaikkan temperaturnya, maka air mulai mendidih dan berubah sifatnya menjadi uap air (H2 O). Dalam perubahan fase dari fase cair ke fase gas temperatur zat tetap dan disebut sebagai titik uap. Kalor yang terlibat dalam perubahan fase ini disebut kalor laten, dalam hal ini disebut kalor penguapan. Sedangkan proses perubahan fase cair ke fase gas disebut menguap.
- Proses sebaliknya adalah perubahan fase gas ke fase cair dan dari fase cair ke fase padat. Perubahan dari fase gas ke fase cair zat melepaskan kalor dan temperaturnya turun. Dalam perubahan fase ini dikenal titik embun dan kalor yang terlibat di dalamnya disebut kalor pengembunan. Proses perubahan fase gas ke fase cair disebut mengembun.
- Sedangkan pada proses perubahan fase cair ke fase padat dikenal titik beku dan kalor yang terlibat di dalamnya disebut sebagai kalor pembekuan. Proses perubahan fase cair ke fase padat disebut membeku. Jika kondisi alam memungkinkan, maka fase gas dapat berubah langsung ke fase padat atau sebaliknya.
- Perubahan dari fase gas ke fase padat disebut menyublim. Dalam peristiwa menyublim dikenal titik sublimasi dan kalor yang terlibat di dalamnya disebut kalor sublimasi. Sedangkan perubahan dari fase padat ke fase gas disebut melenyap (ada orang yang menyebut menyublim). Dalam peristiwa melenyap dikenal titik lenyap (ada orang yang menyebut titik sublimasi) dan kalor yang terlibat di dalamnya disebut kalor pelenyapan (ada orang yang menyebut kalor sublimasi).
Dari
uraian tersebut di atas dikenal temperatur tetap pada perubahan fase zat,
yaitu:
1.
titik embun = titik uap
2.
titk lebur = titik beku dan
3.
titik sublimasi = titik lenyap.
Dari
uraian tersebut di atas juga dikenal istilah kalor laten, yaitu kalor yang
diperlukan atau dilepaskan pada saat perubahan fase zat. Kalor laten tersebut
adalah:
1.
kalor pengembunan = kalor penguapan
2.
kalor lebur = kalor beku dan
3.
kalor sublimasi = kalor pelenyapan.
Konsep temperatur juga dapat
difahami melalui ilustrasi berikut.
Gambar tersebut melukiskan adanya partikel
udara dalam suatu wadah. Masing-masing partikel udara mempunyai massa = m dan
kecepatan = v. Partikel udara bergerak kesana-kemari, bertumbukan
dengan partikel lainnya dan bertumbukan pula dengan dinding wadahnya. Andaikan
tumbukan yang terjadi lenting sempurna, maka kelajuan partikel udara adalah
tetap, cuma arahnya yang berubah.
Partikel udara punya massa dan
bergerak dengan kecepatan tertentu, maka partikel udara mempunyai momentum
sebesar p = m v dan mempunyai energi kinetik
sebesar Ek = ½ m v 2. Andaikan jumlah total massa
partikel udara dalam wadah adalah M dan kecepatan rata-ratanya adalah vave,
maka energi kinetik total partikel udara dalam wadah adalah EK = ½ m vave 2.
Akibat gerakan partikel udara dalam wadah, maka udara mempunyai temperatur
sebesar T. Harga tempertaur ini sebanding dengan energi kinetik total
partikel udara dalam wadah, yaitu:
T = ⅔ EK / k = ⅓ M vave2 / k
Dengan
: k = konstante Boltzmann = 1,37 x 10 –16 erg / atom
K = 1,37 x 10 –16 erg
/ mole
K = 1,36 x 10 –25 L
atm / mole
K = 1,38 x 10 –23 J /
mole K.
2. Hukum ke Nol Termodinamika
Untuk
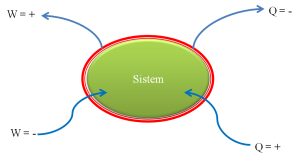
mendalami hukum ke nol Termodinamika perlu diketahui pengertian sistem. Apakah
sistem itu ? Apa yang menjadi objek penelitian atau penyelidikan termodinamika
disebut sistem. Contoh sistem adalah: padatan, cairan, gas, batere, sepotong
logam, dan mesin. Segala sesuatu di luar sistem disebut lingkungan sistem. Oleh
sebab itu, sistem ditambah dengan lingkungan sistem disebut alam atau alam raya
SISTEM +
LINGKUNGAN SISTEM = ALAM RAYA
Antara sistem dan
lingkungan sistem terdapat dinding pemisah dan dapat terjadi interaksi kalor
atau interaksi termal atau interaksi pengadaan usaha. Jika interaksi antara
sistem dengan lingkungan sistem ini dicegah oleh dinding pemisah lainnya,
sehingga tidak terjadi interaksi, maka sistem disebut sistem terisolasi.
Interaksi termal
terjadi apabila dinding pemisah antara sistem dan lingkungan sistem bersifat
diatermik, yaitu dinding yang dapat meneruskan kalor. Pada kontak diatermik,
koordinat masing-masing sistem berubah, karena terganggu. Namun suatu keadaan
sertimbang baru akan tercapai setelah kalor berpindah dari sistem yang panas ke
sistem yang kurang panas. Dalam keadaan setimbang yang baru ini, kedua sistem
memiliki temperatur yang sama.
Informasi
ini dapat digambarkan sebagai berikut :
Pada kontak diatermik diperoleh
hubungan matematis:
(X1’ Y1’) = (X2’ Y2’)
Pada kontak termal melalui
dinding adiabatis, tidak terjadi perpindahan kalor dari sistem yang pertama ke
sistem yang kedua atau sebaliknya, sehingga tidak terjadi perubahan apapun pada
koordinat masing-masing sistem. Akibatnya tidak terjadi hubungan apapun antara
(X1’
Y1’)
dan (X2’
Y2’).
Pada dasarnya
hukum ke nol termodinamika merupakan azas kesetimbangan termodinamik. Azas
tersebut menyatakan, jika dua objek yang terpisah ada dalam keadaan setimbang
termodinamik dengan objek yang ketiga dan mereka ada dalam keadaan setimbang,
maka ketiga objek yang ada dalam kesetimbangan termodinamik mempunyai
temperatur yang sama.
Dengan
gambar, hukum ke nol termodinamika dapat dilukiskan seperti gambar :
Dengan kalimat lain hukum ke
nol termodinamika dapat dinyatakan sebagai berikut. Apabila sistem A berada dalam keadaan setimbang termal dengan sistem B
dan sistem A juga dalam keadaan setimbang termal dengan sistem C, maka sistem B
juga berada dalam keadaan setimbang termal dengan sistem C.
Dari
uraian tersebut di atas, apakah sebenarnya temperatur itu ? Apakah temperatur
dapat dinyatakan sebagai berikut ?
B. Pengukuran Temperatur
Termometer adalah
alat pengukur temperatur. Agar dapat dilakukan pengukuran secara kuantitatif
termometer perlu dilengkapi dengan skala. Bagaimana caranya membubuhi skala
pada termometer ? Apa pertimbangan fisisnya ?
Semua tipe dan jenis termometer
didasarkan pada gejala alam yang berkaitan dengan perubahan sifat fisis suatu
besaran karena adanya kalor yang masuk atau keluar dari besaran tersebut.
Besaran fisis tertentu yang sifatnya dapat berubah karena temperaturnya berubah
atau diubah disebut sebagai besaran termometri (Thermometric Property).
Adapun contoh jenis termometer dan Thermometric Propertynya
dilukiskan seperti tabel berikut.
Masing-masing
jenis termometer memiliki keuntungan dan kekurangannya sendiri-sendiri.
Masing-masing jenis termometer juga mempunyai daerah pengukuran dan batas ukur
yang berbeda-beda. Hal ini disebabkan karena Thermometric Property yang
digunakan juga berbeda.
Jika
Thermometric Property dilambangkan sebagai X, maka X = X (T).
Ini berarti Thermometric Property (X) sebagai fungsi temperatur (T). Demi
kemudahan pembacaan skala pada termometer, X selalu dipilih sebagai
fungsi linier dari T. Pilihan demikian menghasilkan skala termometer
yang dipilih bersifat linier pula. Ini berarti
X = c
T
dengan
kata lain X / T pada setiap keadaan harus bernilai sama, dalam arti
kenaikan satu skala pada termometer selalu sama. Inilah yang dimaksud dengan
fungsi linier.
Dalam
sistem satuan internasional telah disepakati, bahwa titik acuan untuk
temperatur adalah temperatur tripel air. Temperatur tripel air adalah
temperatur air murni yang berada dalam keadaan setimbang termal dengan es dan
uap air jenuhnya. Temperatur ini berharga 273,16 K (Kelvin) dan dapat
direalisasikan dengan menggunakan sel tripel.
Jika
T = temperatur yang hendak diketahui, X = harga Thermometric
Property pada temperatur yang hendak diukur, T1 =
temperatur acuan yang dipilih, dan X1 =
harga Thermometric Property pada temperatur acuan atau temperatur yang
dipilih, maka dengan menggunakan temperatur titik tripel dapat diperoleh
persamaan:
T
= 273,16 (X / X1) K
C.
Syarat-Syarat Termometri
Untuk
mengukur temperatur suatu benda dapat digunakan zat yang sifat fisisnya (thermometric
property-nya) dapat berubah karena perubahan temperatur. Diharapkan
perubahan sifat fisis ini semaksimal mungkin dapat menunjukkan
perubahan-perubahan temperatur yang sekecil mungkin. Oleh sebab itu, dalam
pengukuran temperatur (termometri) dengan menggunakan perubahan sifat fisis
suatu zat diperlukan syarat-syarat termometri sebagai berikut.
1.
Zat yang digunakan,
2.
Sifat fisis zat (thermometric property), dan
3.
Tingkatan kuantitatif yang menyatakan besar kecilnya temperatur.
Ketiga
syarat termometri ini saling kait mengait sulit untuk dipisahkan. Sifat fisis
tergantung pada zat yang digunakan, sedangkan batas-batas ukuran kuantitatif
yang dapat dicapai termometer bergantung kepada zat dan sifat fisis zat yang
digunakan. Oleh sebab itu, dalam pembuatan termometer harus diperhatikan ketiga
syarat termometri tersebut. Adapun zat yang sering digunakan dalam pengukuran
temperatur (termometri) antara lain:
1.
zat padat, misalnya: platina dan alumel.
2.
zat cair, misalnya: airraksa (raksa) dan alkohol
3.
zat gas, misalnya: udara, zat air, dan zat lemas.
Sifat-sifat
fisis zat yang sering digunakan dalam pengukuran temperatur (termometri) antara
lain:
1.
perubahan volume gas.
2.
perubahan tekanan gas.
3.
perubahan panjang kolom cairan.
4.
perubahan harga hambatan listrik atau hambatan jenis.
5.
perubahan gaya gerak listrik.
6.
perubahan harga kuat arus listrik.
7.
perubahan intensitas cahaya karena perubahan temperatur.
8.
perubahan warna zat.
9.
perubahan panjang dua logam yang berlainan jenisnya.
Tingkatan
yang menyatakan besar kecilnya temperatur ditunjukkan oleh nilai atau harga
temperatur. Penentuan harga ini harus dapat direproduksi, artinya, jika
temperatur dari suatu keadaan sudah dinyatakan dalam suatu harga, misalnya 500C,
maka setiap kali kita memperoleh harga itu, keadaan sesungguhnya harus tepat sama
dengan keadaan semula atau sebaliknya.
Dalam pengukuran temperatur ada
korespondensi timbal balik antara keadaan temperatur dan angka atau harga
temperatur itu serta keajegan penunjukkannya. Untuk ini diperlukan suatu
patokan yang tetap. Dengan patokan harga yang tetap, pengertian tentang patokan
itu sendiri, dan perkembangan ilmu yang mendasarinya, maka timbul
bermacam-macam jenis termometer, timbul berbagai macam derajat temperatur, dan
masalah-masalah lainnya yang berkaitan dengan pengukuran temperatur. Oleh sebab
itu, akan dibahas tentang jenis-jenis termometer, derajat temperatur, dan skala
temperatur.
sumber : Hamid, Ahmad Abu. 2007. DIKTAT PERKULIAHAN TERMODINAMIKA : KALOR DAN TERMODINAMIKA. YOGYAKARTA: FMIPA UNY.